
蛋白质构象对于生物识别、结合和催化反应等至关重要;生物酶的催化活性和底物识别特异性等高度依赖于蛋白质的折叠结构。根据Anfinsen假说,蛋白质的氨基酸序列决定了折叠结构和生物学功能,而处于天然状态下的蛋白质具有最低自由能的构象。然而,近期研究表明生物体系中的某些蛋白质并不会聚集成热力学稳定的沉淀物或淀粉样蛋白,而是被捕获在动力学陷阱中,呈现出具有更高生物活性的状态。

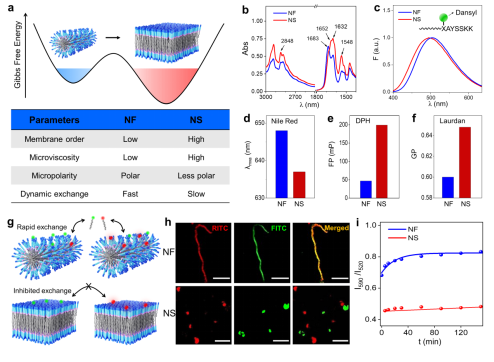
近日,林艺扬课题组报道了具有催化活性的小分子多肽,他们在热力学和动力学控制下形成迥异的超分子纳米结构,分别是处于动力学陷阱的一维纳米纤维和具有热力学稳定的二维层状结构。其中,纳米纤维具有较高的分子动态性和界面结合水,从而具备类似水解酶的催化活性;而二维层状结构具有更强的分子间氢键,不利于分子动态交换,并降低纳米结构的内部极性,这些都抑制了多肽催化底物水解的能力。在升温条件下,具有高催化活性的纳多肽纤维可以转变成低活性的层状结构,这个过程具有不可逆性,这个现象类似于蛋白质在高温条件下的变性。文章指出,多肽超分子结构的微极性、微粘度、分子动态等性质影响底物对催化位点的亲和能力,而界面水分子可能参与催化水解反应。这项工作阐明了热力学和动力学控制下设计不同催化活性的多肽纳米结构的理念。
bwin必赢中国官网的硕士研究生(已毕业)陈靖为论文的第一作者,林艺扬教授为论文的通讯作者,文章合作单位包括中科院物理所,澳大利亚新南威尔士大学和美国里海大学。研究工作得到了国家高层次人才计划青年项目、中央高校基本科研基金和国家自然科学基金的支持。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202317887