
光动力治疗(PDT)是一种利用光激发光敏剂产生有毒的活性氧以实现治疗的方法,在癌症治疗领域展现出巨大潜力。然而,作为光动力治疗核心的光敏剂仍存在一些问题。一方面,大多光敏剂荧光、光动力呈现 “Always-On”状态,可能降低成像效果且带来一定光毒副作用;另一方面,由于尺寸效应,现行光敏剂难以兼具肿瘤富集与深层渗透性能,削弱其光动力治疗效果。因此,针对以上问题,设计制备智能高效的光敏剂,并对其性能进行精准调控,从而达到最佳诊治效果,是当前光动力诊疗领域的研究热点和难点。
近日,必赢官网尹梅贞教授和苏志强教授与国家纳米科学中心陈春英研究员合作报道了一种基于苝单酰亚胺的智能纳米簇,并将之应用于可活化,可深层渗透的光动力肿瘤治疗,同时提出了酶触发分子解组装的多功能级联控制的诊疗策略(图1)。作者设计合成了一种近红外四氯苝单酰亚胺分子P1作为羧酸酯酶(CE)响应的前驱体,并将其与叶酸修饰的白蛋白共组装成纳米簇光敏剂(FHP);一旦P1被CE水解,FHP将由~100 nm的纳米簇转变为~10 nm的超小纳米粒子,使FHP可兼顾有效的肿瘤富集和深层渗透;同时,酶触发解组装过程还使FHP荧光发射增强~8倍,光动力性能提升~4倍,实现了近红外荧光成像引导的活体光动力治疗,显著抑制了小鼠肿瘤生长(图2)。
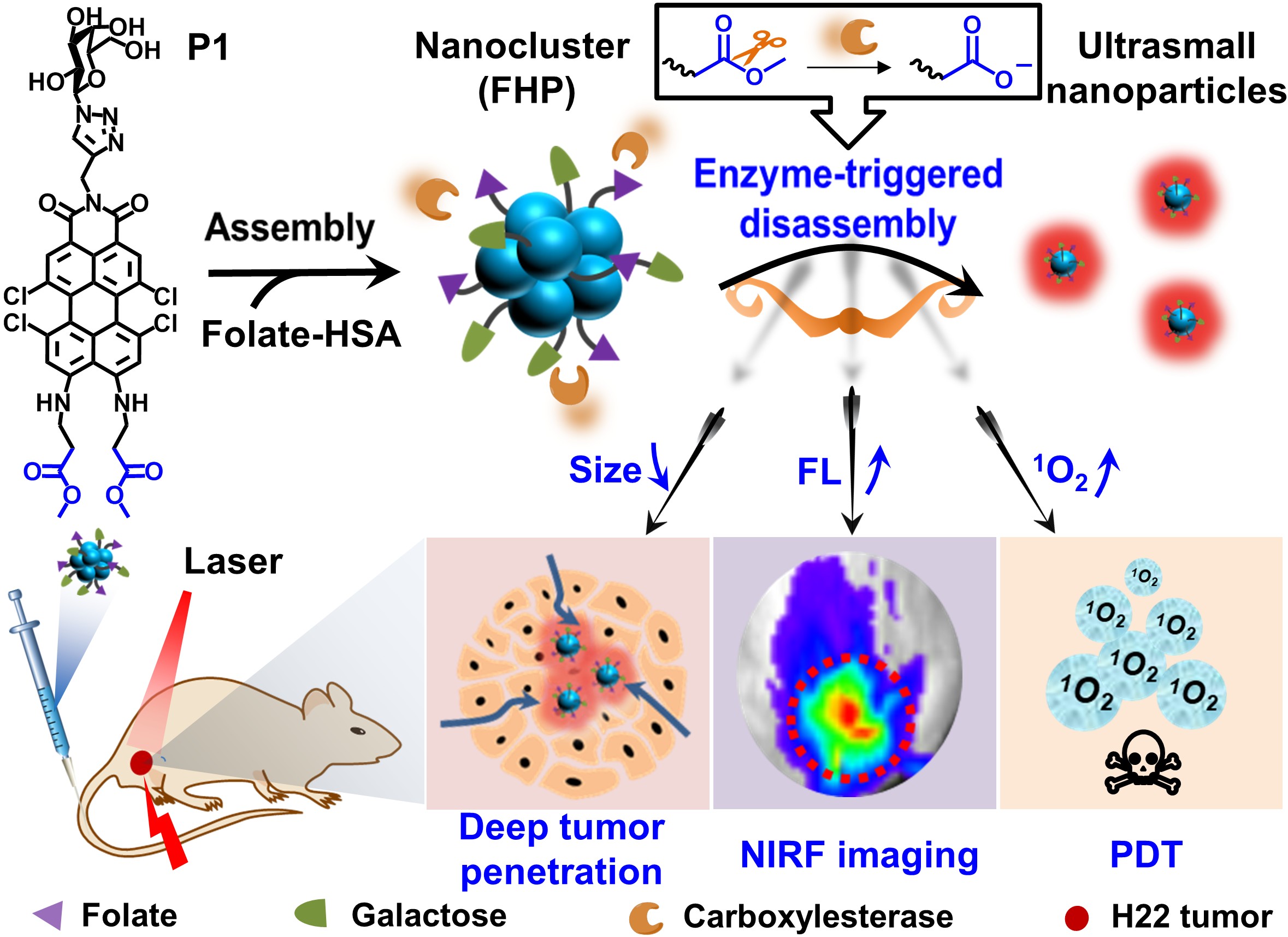
图1. FHP的制备,酶触发解组装,肿瘤渗透及活化的光动力诊疗示意图
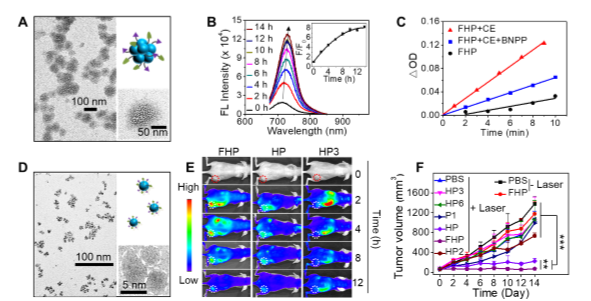
图2. (A) FHP纳米结构;CE作用前后FHP(B)荧光增强,(C) 光动力性能提升,(D)尺寸缩减;(E)实时近红外荧光活体成像;(F)光动力肿瘤治疗
该研究工作基于苝单酰亚胺,从酶促结构转变调控分子组装的角度去设计制备新型光敏剂,验证了酶触发分子解组装的多功能级联控制策略在光动力诊疗应用中的可行性,为解决当前光动力治疗问题提供了新思路,也为未来癌症诊疗中研发刺激响应型纳米药物提供了新途径。
相关成果以“Enzyme-Triggered Disassembly of Perylene Monoimide-based Nanoclusters for Activatable and Deep Photodynamic Therapy”为题发表于国际顶尖期刊Angew. Chem. Int. Ed.(IF = 12.959)上。本文第一作者为必赢官网博士生蔡阳和国家纳米科学中心博士生倪东齐,必赢官网尹梅贞教授、苏志强教授与国家纳米科学中心陈春英研究员为共同通讯作者。
原文链接:https://doi.org/10.1002/anie.202001107