
高性能递送载体的构建已成为化学、材料学、生物学、医学等多学科综合交叉领域的前沿和热点。为了解决传统化疗常常“敌我不分”,治疗效率低下且毒副作用明显的问题,多模式治疗的概念被提出并受到广泛关注。近年来,科学工作者利用阳离子递送载体的可设计性、可修饰性,将有机光敏剂、光热试剂、放/化疗药物等功能物质引入到阳离子核酸递送系统中,以实现对靶细胞的多模式治疗。体内外实验结果表明这种多模式治疗系统具有优良的效果,但同时也存在着制备过程中,为了实现构建多功能递送载体的目标,需要通过复杂的物理、化学方法对递送载体进行修饰。递送载体在引入这些疏水功能分子以后不可避免的改变自身理化性质。是否能够设计可以同时表达多种光热、光敏或基因编辑蛋白的新型功能质粒,通过递送载体导入靶细胞后,在同一个靶细胞表达多个功能蛋白实现基因的多模式治疗是本研究的出发点。
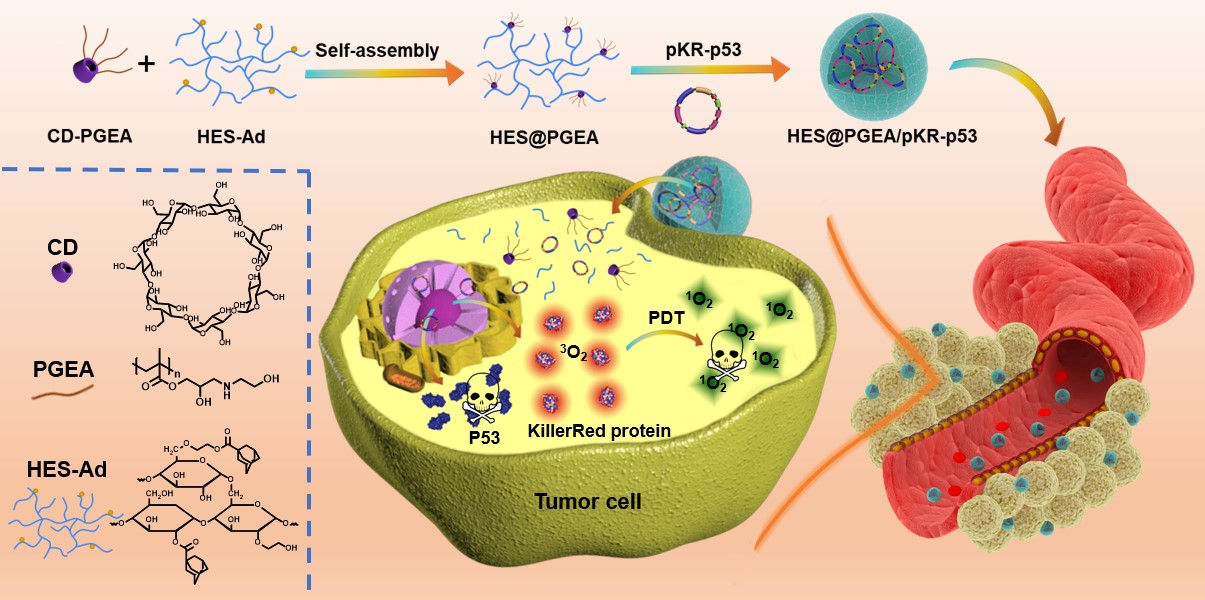
图1. 超分子核酸纳米递送系统的构建及肿瘤多模式治疗过程
如图1所示,徐福建教授团队以金刚烷修饰的羟乙基淀粉(HES-Ad)和乙醇胺功能化的β-环糊精基聚甲基丙烯酸缩水甘油酯(CD-PGEA)为出发点,通过超分子组装的方式得到新型多糖基阳离子递送载体(HES@PGEA)。该载体通过携带自行设计的可分别表达光敏蛋白(KillerRed,KR)和肿瘤抑制蛋白(P53)的质粒(pKR-p53)进入肿瘤,实现基因调控下的细胞凋亡/光动力杀伤的双模式治疗。
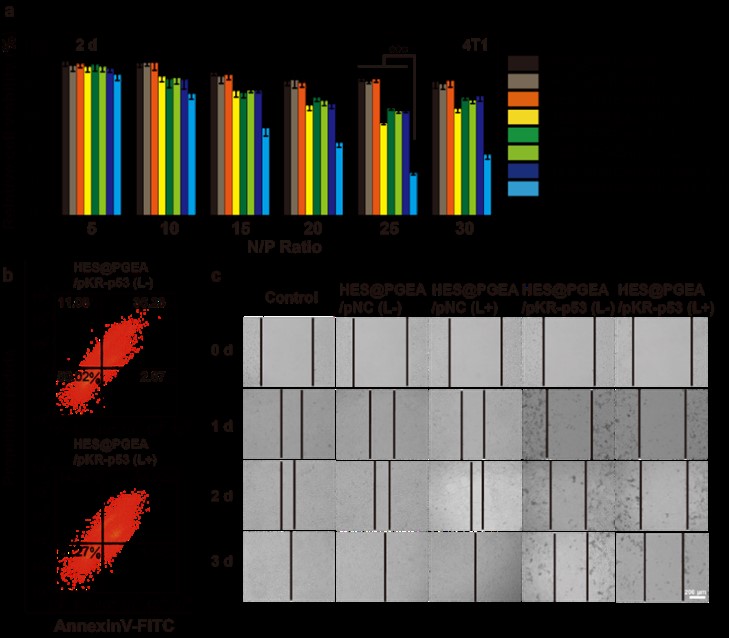
图2. 体外肿瘤细胞抑制实验的相关结果
通过体外肿瘤细胞抑制实验的相关数据可以得知(图2),相比于单独递送p53抑瘤基因和单独递送pKR基因并进行光动力治疗的治疗效果,本研究所构建的“pKR-p53”一体化质粒能够在载体的携带下在同一细胞中同时表达两种蛋白达到协同的抑瘤效果。
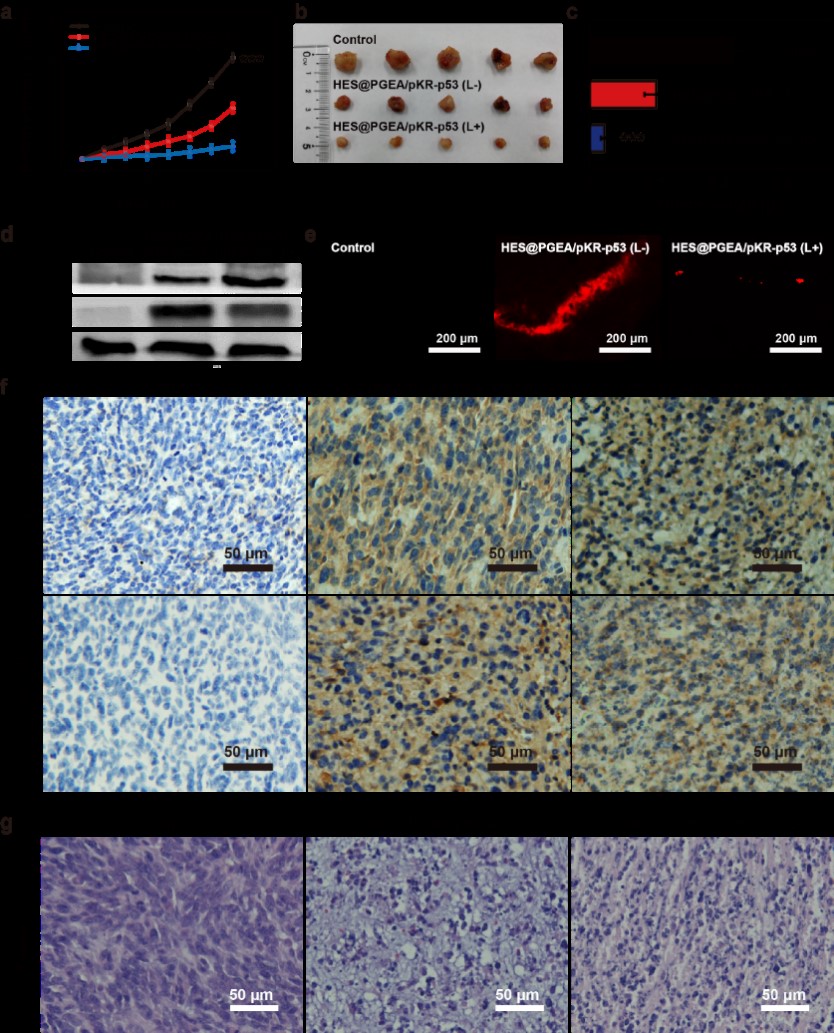
图3. 体内抑瘤实验的相关结果
研究团队进一步在荷瘤小鼠体内验证了这种基因多模式治疗策略的可行性。如图3所示,利用所构建的高效HES@PGEA载体可以成功递送pKR-p53质粒进入肿瘤组织细胞,表达两种相关蛋白。在光照调控下,该双模式治疗策略取得了良好的抑瘤效果。这种基因多模式治疗系统的提出为肿瘤以及其他疾病的治疗提供了新的治疗策略和思路。
以上相关成果以“Genetically multimodal therapy mediated by one polysaccharides-based supramolecular nanosystem”为题发表在Biomaterials (https://doi.org/10.1016/j.biomaterials.2020.120031)上。论文的第一作者为bwin必赢中国官网的许晨博士和硕士研究生胡文婷,通讯作者为徐福建教授和俞丙然副教授。